
400-168-9509

400-168-9509
行业关注
全国服务热线:
当前位置:首页>行业关注


大多数人的记忆力都会随着年龄增长而逐渐衰退。近日,来自波恩大学和耶路撒冷希伯来大学的科学家在小鼠中证明,大麻可逆转大脑中的老化过程。用大麻活性成分进行长期低剂量治疗老龄小鼠能够使它们的大脑“返老还童”,回到两个月大小鼠的状态。这一发现为治疗痴呆症等疾病开辟了新的道路。这项研究结果发表在Nature Medicine上。
和其他任何器官一样,我们的大脑也会衰老,认知能力随着年龄的增长而逐渐降低。老年人更难学习新事物,也更难同时将注意力放在几件事情上。这一过程虽然是自然现象,但也可能促进痴呆症发生。研究人员一直在寻找减缓甚至扭转大脑衰老的方法。
现在,波恩大学和耶路撒冷希伯来大学的科学家已经在小鼠中实现了这一点。这些动物寿命相对较短,在十二个月大时它们就会显示出的认知缺陷。研究人员在四周的时间内将少量THC(大麻中的活性成分)用于2个月、12个月和18个月的小鼠。之后,他们测试了动物的学习和记忆能力,包括导向技巧和对其他小鼠的识别。给予安慰剂的小鼠表现出与自然年龄相关的学习和记忆丧失。相比之下,用大麻治疗的动物的认知功能与两个月大的对照动物一样好。波恩大学分子精神病学研究所的Andreas Zimmer教授报告说:“大麻治疗完全逆转了老年动物的认知功能丧失。




5月8日,Nature Medicine杂志在线发表了一篇“大作”,科学家们采用综合法——MSK-IMPACT开展了一个大规模的、前瞻性的临床测序项目,收 集了10000多名晚期癌症患者的肿瘤及正常组织DNA序列、病理以及临床注释等各方面的数据。使用这些数据,他们确定了临床相关的体细胞突变、新的非编码区突变以及常见肿瘤与罕见肿瘤共享的突变标签。让人兴奋的是,研究人员将所生成的数据集对外共享(共享网址:http://cbioportal.org/msk-impact),使人们能够发现新的生物标志物以及针对罕见突变开展更深入的研究。
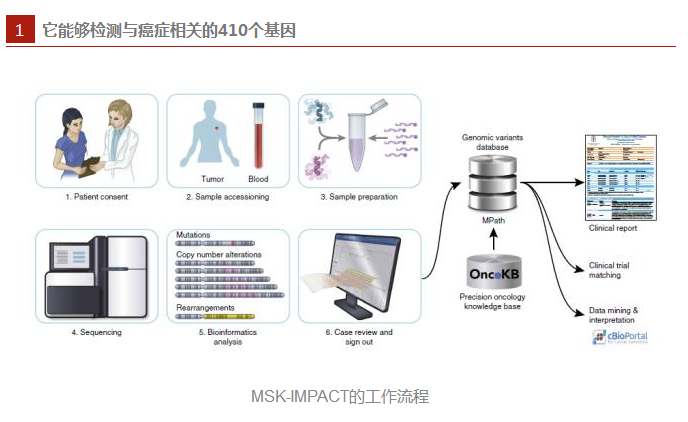
首先来看看什么是MSK-IMPACT。这项技术是科学家们在纪念斯隆-凯特林癌症中心开发,是一种基于NGS panel的杂交捕获技术,可检测与癌症相关的341个基因中的所有蛋白质编码突变、拷贝数变异、启动子突变以及结构重排。不过根据发现,目前这种方法已经能够检测与癌症相关的410个基因。
从MSK-IMPACT的工作流程图我们可以看到,患者首先要签订肿瘤与正常序列配对分析的知情同意书,然后研究人员收集患者的血液样本作为正常DNA的来源,利用自动化的方法来提取肿瘤和血液样本的DNA,并使用靶向410个基因的所有编码外显子的杂交探针来制备文库,随后是测序、数据分析。所生成的数据结果加载到自家开发的基因变异数据库中,并手动检测数据的质量和精度。基因组变化会在电子病历报告中显示,并被发送到机构开发的数据库中,这有利于自动化临床试验匹配,变异数据还会自动上传到cBioPortal中进行挖掘以及解读。
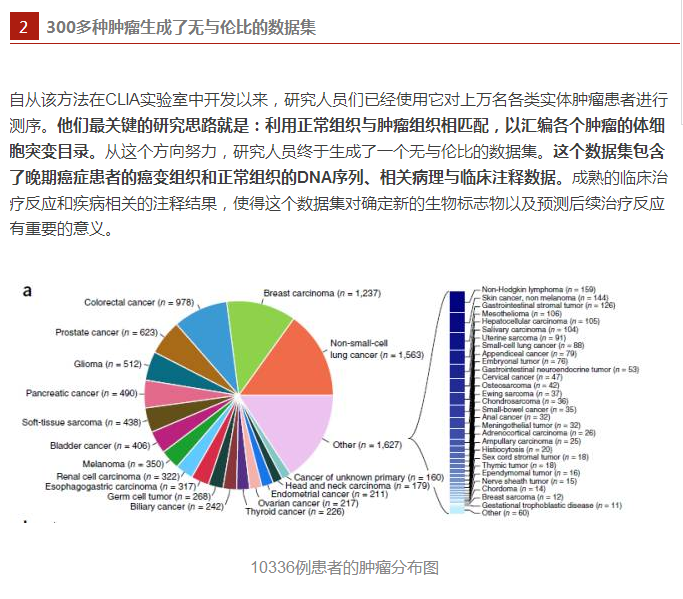
上图勾勒了本文中成功测序的10336例患者的肿瘤分布类型,包含62种主要肿瘤类型,又细分为361种类型。
与以往的大规模基因组鉴定研究不同,这项研究所涉及的数据全部来自晚期患者,他们有可能是分子靶向治疗的代表人群。另外,这项研究包含了300多个详细的肿瘤类型,这有助于人们理解驱动突变在所有癌症中的发生率,还有助于检测罕见以及不曾预料到的临床可行性突变。
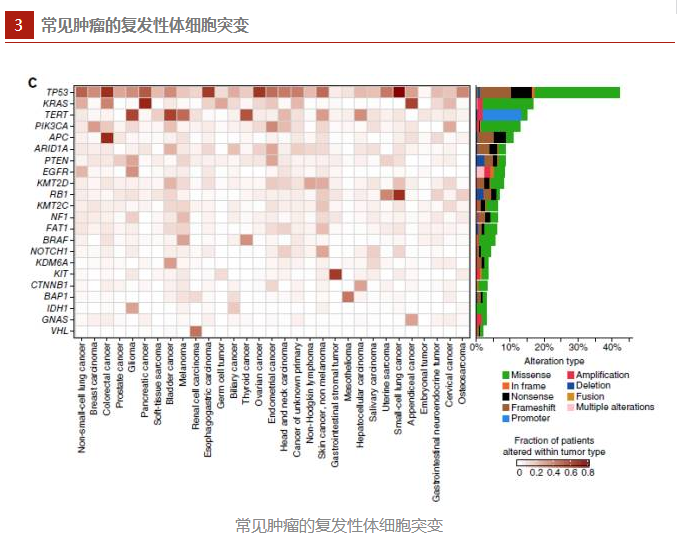
研究人员发现,在MSK-IMPACT研究队列中,突变频率高的基因是TP53。TP53基因突变常发生在别浆液性卵巢癌患者中(98%),其次是发生在食管腺癌(89%)和小细胞肺癌(85%)中。总之,在62种主要的肿瘤中,有43种发生TP53突变的概率大于10%。
KPAS基因突变是第二个常见的突变(15%)。KPAS基因突变在胰腺癌中为常见(90%),其次是在结直肠癌中(44%。)。KPAS基因在所有肿瘤测序中密码子突变较为频繁,其次到PIK3CAH1047、PIK3CAE545和BRAFV600,它们至少在20个主要肿瘤类型中发生突变。
此外,研究人员们还分析了TERT突变、激酶的融合与重排、突变标签和体细胞超变以及临床可行性和效用性。
他们表明,企业规模的肿瘤测序是可行的,以及利用综合的癌症panel来匹配血液样本也是可行的。通过这种方式,他们生成了一个广阔的数据集,包含了10945个肿瘤的突变、拷贝数变异以及基因组重排。
研究人员表示,虽然这项研究迈出了评估大规模前瞻性肿瘤测序的临床影响的一步,但仍需要更多的研究来评估癌症基因组学对患者预后的长期影响。这些研究需要详细的纵向随访。此外,肿瘤测序的数据共享十分重要,只有共享才能发挥数据集的巨大潜力。

5月7日,发表在Advanced Materials杂志上的一项题为“Red Blood Cells for Glucose-Responsive Insulin Delivery”的研究中,来自美国北卡州立大学及北卡大学教堂山分校的研究人员开发了一种新技术:利用修改版的胰岛素和红细胞创建了一个葡萄糖响应的智能胰岛素递送系统(glucose-responsive “smart” insulin delivery system)。

顾臻教授
动物模型研究表明,这一新技术能在1型糖尿病小鼠中有效降低血糖水平长达48小时。“80后”华人科学家顾臻教授是这一研究的通讯作者。
具体来说,研究人员通过用化学方法将胰岛素绑定到一种称为葡萄糖胺(glucosamine)的葡萄糖衍生物上。然后,葡萄糖胺能够绑定到红细胞表面的葡萄糖转运蛋白上,有效地将胰岛素连接到血细胞上。这一设计的结果是,产生了一个布满胰岛素分子的红细胞。
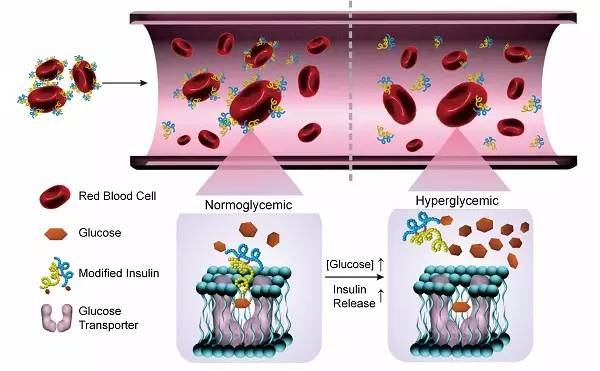
科学家们希望,这些装载了胰岛素的血细胞能够被注射到糖尿病患者中,发挥治疗作用。在当前的这一研究中,研究小组在1型糖尿病小鼠中初步证实了这一想法的可行性。
一旦进入血液中,携带胰岛素的血细胞会与它们的环境相互作用。如果血糖水平很高,葡萄糖分子会有效取代血细胞葡萄糖转运蛋白上的葡萄糖胺。当葡萄糖胺从血细胞中释放出来,胰岛素也会随之释放。然后,胰岛素能够与肝脏、肌肉和脂肪组织中与胰岛素受体结合,从而触发降低血液中葡萄糖水平的反应。
顾臻教授说:“简言之,这是一个完全不会引起排斥的智能系统。系统在需要时发生响应,使血液中葡萄糖水平正常化。”
在这一研究中,科学家们将接受这一“智能系统”的治疗小鼠与其它三组小鼠进行了比较:1)接受盐溶液(saline solution)处理的小鼠;2)只接受修改版胰岛素处理的小鼠;3)接受未修改版胰岛素与红细胞混合物处理的小鼠。
结果发现,接受“修改版胰岛素-红细胞智能系统”处理的1型糖尿病小鼠能够在超过2天内显著降低血糖水平。其它组小鼠的“表现”是,血糖水平有所下降,但会在12小时内恢复到高血糖水平。
研究人员还在一组健康小鼠中测试了每一种组合。结果发现,与其它组合相比,“修改版胰岛素-红细胞智能系统”降低了低血糖风险。顾臻教授透露,研究小组正在探索利用无痛微针(microneedles)来递送这一系统,而不是依赖于这一研究中所使用的传统注射。
智能胰岛素贴片
据了解,顾臻教授长期致力于智能递药体系的创新研发,曾入选MIT Technology Review杂志评选出的2015年度全球杰出青年创新人物(35 Innovators Under 35)。研究小组开发出的“智能胰岛素贴片”曾入选《科学》杂志“2015年十大图片”(Top 10 images of 2015)。
研究成果于2015年发表在PNAS杂志上。关于“智能胰岛素贴片”的原理、创新性、临床转化等问题,顾臻教授曾在接受生物探索采访时进行了详细的解答。详见:专访北卡大学顾臻教授:“智能胰岛素贴片”或将终结糖尿病治疗注射时代
近年来,顾臻教授研究组取得了一系列糖尿病治疗研究成果。他曾从120多名全美研究者中脱颖而出,获得了由美国糖尿病学会颁发的2015年度“Pathway Award"大奖,成为了全美荣获该奖项的6位杰出研究者之一,并获得了162.5万美元的科研奖金。去年,顾臻教授荣获了2016年斯隆研究奖(Sloan Research Fellowships)。
同年,基于上述“智能胰岛素贴片”技术,研究小组又开发出了“智能β细胞贴片”。相关成果于去年4月23日发表在Advanced Materials杂志上(论文题目:Drug Delivery: Microneedles Integrated withPancreatic Cells and Synthetic Glucose-Signal Amplifiers for Smart InsulinDelivery)。
除了糖尿病,研究组还将“贴片”的概念应用到了癌症治疗上。相关成果于去年3月发表在Nano Letters杂志上(论文题目:Enhanced Cancer Immunotherapy by Microneedle Patch-Assisted Delivery of Anti-PD1 Antibody)。
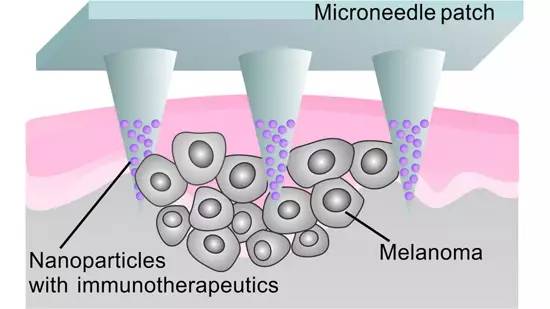
研究中,科学家们首先将PD-1抗体与葡萄糖氧化酶一起装入纳米颗粒中,再将纳米颗粒装到微针中,将这些微针排列在贴片表面(上图)。使用时,血液会进入微针,血液中的葡萄糖在葡萄糖氧化酶的作用下产生酸,慢慢分解纳米颗粒。随着纳米颗粒逐渐被降解,PD-1抗体即可被释放到肿瘤中。
研究人员在黑色素瘤小鼠模型中测试了该技术,比较了微针贴片注射、将PD-1抗体直接注射到血液中以及将包含PD-1抗体的纳米颗粒直接注射到肿瘤处三种方法的差异。40天后,40%经微针贴片注射的小鼠存活下来,且没有检测到残余的黑色素瘤;而对照组小鼠存活率为零。
此外,研究人员还检测了一种鸡尾酒疗法,即将纳米颗粒中同时填充了PD-1抗体和另一种免疫疗法CTLA-4抗体。采用微针贴片治疗40天后,70%的小鼠存活下来,且没有检测到残留的黑色素瘤。

作者:汪凯,辛涛,解放军第401******神经外科
神经系统退行性疾病是由慢性进行性神经组织退变所导致的疾病,包括帕金森病(Parkinson's disease,PD)、阿尔茨海默病(Alzheimer's disease,AD)、亨廷顿病(Huntington's disease,HD)、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)、多发性硬化(multiple sclerosis,MS)等,均是由于脑或脊髓的神经元或胶质细胞的丢失所导致。
针对神经系统疾病的细胞移植和基因转导治疗的研究已广泛开展并取得了良好结果,但细胞来源问题却成了发展的障碍。多年来,人们已成功地从胚胎干细胞、间充质干细胞等多种干细胞分化得到了神经元或胶质细胞,并用于治疗神经系统疾病的研究。此文中,我们回顾了针对帕金森病等神经系统退行性疾病的干细胞移植治疗的相关研究,探讨了干细胞治疗神经系统退行性疾病的应用前景。
干细胞被定义为能够自我更新并向多种细胞分化的一类细胞。胚胎干细胞(embryonic stem cells,ESCs)和胚胎生殖细胞(embryonic germ cells,EGCs)分化成多种器官与组织的能力已经被证实。还有后来出现的诱导多能干细胞(induced pluripotent,iPSc),该细胞是通过向成体细胞(如皮肤成纤维细胞)导入胚胎发育相关基因而得到的。
除上述细胞之外,处于更高发育阶段的各组织中也可分离出相应的组织特异性干细胞,如造血干细胞、脐带血间充质干细胞、骨髓间充质干细胞和神经干细胞等等。Shu等的报道带给干细胞领域一个新的惊喜,他们仅使用四个分子化合物就成功地将分化成熟的小鼠成体细胞诱导成为可以重新分化发育为各种组织器官的,即处于去分化状态的“多潜能”细胞,更令人惊奇的是他们利用这种细胞成功地培育出了小鼠。研究显示,神经干细胞存在于人的胚胎和成人脑内。
上世纪90年代,出于诊断的目的,研究者向一部分癌症患者体内输入了5-溴脱氧尿苷,这些患者死后的检验证据显示在成人神经系统内有新生神经元不断产生。但是为什么成年患者的神经系统在损伤(外伤或疾病)后的自我修复能力是有限的?原因可能是在脑部内环境中,诱导神经干细胞增殖并向神经元分化的力量太弱所致。通过导入原癌基因,研究者获得了能不断分裂增殖的永生化神经干细胞系,并且已证实在移植入动物模型体内后可以定植并分化成神经元和胶质细胞。细胞移植和基因治疗这些策略均可用于治疗神经退行性疾病,包括:PD、AD等。该综述回顾了干细胞治疗神经系统退行性疾病的相关研究。
一、帕金森病(PD)
PD的主要病理特征是黑质的多巴胺(dopamine,DA)能神经元的大量丢失,从而引起纹状体内多巴胺的含量显著减少而致病,我国此类患者超过300万人。原发性PD的病因学还不明确,但倾向于如下几点:程序性细胞死亡、病毒感染以及环境毒作用。左旋多巴(levodopa,L-DOPA)虽然有一定成果,但长期应用会出现严重的副作用。
20世纪80年代,通过移植胎脑组织治疗PD患者获得了良好的效果。但因为伦理、宗教原因使细胞来源存在障碍。此外,有报道显示移植后的胎脑细胞在患者脑内的存活率非常低,而且,要获得足够的用于移植的胎脑组织也并非易事。利用ESCs,间充质干细胞(mesenchymal stem cells,MSCs)或者神经干细胞(neural stem cells,NSCs)分化得到DA神经元无疑是规避这些障碍的好办法。研究者已用过表达核受体相关因子1(nuclear related receptor 1,Nurr1)、B细胞淋巴瘤-特大型(B-cell lymphoma-extra large,Bcl-xL)等方式从干细胞得到多巴胺能神经元,在移植到帕金森病模型大鼠脑内后获得了一定程度的功能恢复。
Kim等人还通过基因工程技术,用cDNA同时转导人类络氨酸羟化酶(tyrosine hydroxylase,TH,一种儿茶酚胺合成过程中的限速酶)和三磷酸鸟苷环化水解酶1(guanosine triphosphate cyclohydrolase 1,GTPCH1--四氢生物喋呤(tetrahydrobiopterine,BH4)合成过程中的首要限速酶)得到了能够产生L-DOPA的人神经干细胞系,把该细胞移植入PD模型大鼠脑内可以提高左旋多巴的浓度并带来长时间的功能恢复。
二、阿尔茨海默病(AD)
AD以遍及整个大脑的神经元和突触的变性、丢失为特点,尤其是基底节区、杏仁核、海马等区域。临床表现为进行性记忆和认知障碍,逐渐形成痴呆并早亡。除了胆碱酯酶抑制剂之外,目前没有有效的治疗措施,但此药也只起到临时的效果而无法解决根本问题。AD的发病机制假说提出,该病是由异常的Aβ蛋白聚集所导致。因此,减少脑内的Aβ蛋白水平是可行的治疗策略。有研究显示,用抗Aβ抗体治疗转基因PD模型小鼠可以恢复海马的乙酰胆碱释放并增强小鼠的学习能力。
也有证据表明蛋白酶类也可作为治疗靶点以减少AD脑内的Aβ水平,比如肾胰岛素残基溶酶、纤溶酶等。向脑内有淀粉样斑块沉着的转基因Aβ小鼠的脑内注射过表达人肾胰岛素残基溶酶基因的成纤维细胞可以显著减少其淀粉样斑块。神经生长因子(nerve growth factor,NGF)可以阻止动物老化模型、兴奋性毒素中毒模型和淀粉样蛋白中毒模型的神经死亡并且促进其记忆功能改善,因此显示NGF可以用于治疗AD。然而,限于其分子大小和所带电荷,NGF无法透过血脑屏障。但基因治疗技术可以解决这个问题,利用基因修饰细胞,NGF分子可以直接进入大脑并弥散2~5毫米的距离。
其后的一项临床试验显示,基因修饰后可以表达人NGF的成纤维细胞植入患者脑内后认知减退的程度有所降低,同时,正电子发射计算机断层显像(positron emission tomography,PET)扫描显示治疗后患者皮层代谢显著升高。相对于成纤维细胞,干细胞具有更好的迁移能力,因此,可以考虑被用于导入NGF从而治疗AD。
三、亨廷顿病(HD)
HD是一种常染色体显性遗传性神经退行性疾病,表现为无意识舞蹈样动作、认知缺陷、情绪障碍。但是发病机制仍未明了,因此也无有效的治疗措施。虽然胎脑细胞移植表现出了明确的成果,但因为使用人类胚胎组织而带来的伦理学问题是障碍。因此,神经干细胞应该是理想的细胞来源,因为它不但参与正常神经系统的发育而且可以根据环境调节分化成适当的细胞类型。
有研究表明哺乳动物的神经干细胞可以起到治疗作用,并且对兴奋性毒素红藻氨酸(kainate,KA)或喹啉酸(quinolinic acid,QA)破坏纹状体所制作的HD动物模型都具有明确的成果,其中包括单纯的神经干细胞移植、基因修饰后能够分泌神经营养因子的神经干细胞移植等等手段,并且静脉注射的输入方式侵袭性很小。以上这些提示我们,通过移植过表达神经营养因子的神经干细胞进行应该能够有效阻止HD患者脑内的病理改变。
四、肌萎缩侧索硬化(ALS)
ALS又名为卢·格雷格病,是成年起病的渐进而无情的神经退行性疾病,表现为神经运动神经元的变性丢失,逐渐产生肌肉萎缩、肌力下降。因为ALS的发病机制仍未阐明使得无法提出有效的治疗手段,但多数研究集中针对如下原因:氧化应激、蛋白聚集、线粒体功能障碍、轴浆运输受损、谷氨酸介导的兴奋性中毒和神经营养因子生成不足。
因为干细胞具有多向分化潜能的特性,研究者把小鼠胚胎干细胞来源的运动神经元移植入运动神经元损伤的大鼠、或者把来自胚胎的神经干细胞分化形成的神经元移植入ALS模型小鼠均获得促进ALS动物模型功能恢复的效果。此外,通过移植的干细胞或来源于干细胞的运动神经元所分泌的神经营养因子治疗运动神经元损伤或丢失的方法也是有效的。因此,神经干细胞移植这种没有副作用的治疗方式对ALS患者来说是可以考虑采用的。
五、多发性硬化(MD)
MD以少突胶质细胞和髓鞘磷脂的炎性破坏为特点。而β-干扰素只能改善部分患者的临床症状。因此,找到有效的治疗措施是亟待解决的问题。有研究者把分离自人胎脑的少突胶质前体细胞或组织碎块植入存在基因缺陷的shiverer突变小鼠脑内发现可以诱导髓鞘再生。但是该方法依然受制于伦理、宗教等障碍。此外,胚/胎脑组织中不可避免地混有多种神经元、胶质细胞以及神经前体细胞,使得移植治疗的结果无法预测。而这个困难可以通过采用来源于干细胞的少突胶质细胞的方法来解决,后来的研究也提供了相应的依据:少突胶质细胞可以由人或小鼠的胚胎干细胞、骨髓间充质干细胞等分化得到。而且此类细胞的应用也为MS患者的治疗带来了希望。
六、展望
干细胞移植和基因治疗广泛开展应用之前必须明确两点:一,何种类型的干细胞用于移植***理想;第二,干细胞移植的成瘤性问题。除了神经干细胞,神经元可以从多种干细胞获得:胚胎干细胞、骨髓间充质干细胞、脐带血间充质干细胞、诱导多能干细胞等等,因此我们面临一个选择的问题:究竟哪种细胞***适合用于移植治疗。鉴于神经干细胞在脑内的存在部位已经明确,所以从成体神经干细胞分化得到神经元和胶质细胞只是时间问题。既然干细胞可以从成体组织中分离得到,为什么我们依然从胚胎组织分化得到需要的干细胞呢?
迄今为止的大多数研究均显示,胚/胎来源的干细胞比它们在成体的复本细胞更具可塑性和多能性。先前的研究已经证实,来源于胚胎干细胞或神经干细胞的神经元或胶质细胞具有自我更新能力并可用于治疗各种神经系统疾病,包括:帕金森病、亨廷顿病、肌萎缩侧索硬化、阿尔茨海默病、多发性硬化等等。然而,应用干细胞治疗相关疾病仍然面临各种障碍:①干细胞来源的神经元或胶质细胞移植到宿主脑内后的长期存活率和表型稳定性还不是十分理想;②虽然干细胞来源的神经细胞经过了高度纯化,但依然可能含有杂质细胞,并且它们与宿主之间的相互作用是无法预料的。③少数干细胞可能在移植后不但不分化反而形成肿瘤。
众所周知,外源性信号和内源性遗传信号在神经系统细胞分化多样性上扮演着重要角色。把相关信号分子或者调控基因导入干细胞从而获得目标细胞已经成为可能。在未来的研究道路上仍有许多工作等待我们去完成,比如进一步明确有关干细胞增殖、分化、整合的信号分子;探究宿主脑内***适合移植干细胞存活、增殖以及修复损伤所需的内环境等等。